O desenvolvimento de novos radiofármacos sintéticos para a terapia do câncer
30 de Agosto de 2019
Em células normais a divisão e proliferação celular é um processo coordenado e regulado por uma maquinaria genética, de base bioquímica. As células que sofrem um processo de divisão geneticamente descontrolado têm a chamada transformação neoplásica, proliferando-se excessivamente e formando tumores que podem comprimir ou invadir estruturas adjacentes normais. Assim, o câncer é caracterizado por um desvio nos mecanismos de controle da proliferação e da diferenciação das células.
No Brasil, as neoplasias representam a segunda maior causa de morte por doenças, atrás somente das doenças do aparelho circulatório. A estimativa é de que em 2030 serão notificados 27 milhões de novos casos de câncer e 17 milhões de mortes por câncer no mundo, segundo a Organização Mundial da Saúde.

Dentre as modalidades de tratamento dessa anomalia, a rádio e a químio são as terapias mais utilizadas. A rádio, por ser uma forma de tratamento do câncer capaz de destruir células tumorais por meio de feixes de radiação ionizante, é uma das mais eficientes. A teleterapia (radioterapia externa) e a braquiterapia (interna) ainda hoje são as principais formas de aplicação da radioterapia.
Mas, nesse tratamento também pode ser utilizada a Terapia por Radionuclídeos (TR) ou radioterapia alvo. A TR consiste em danificar ou destruir as células neoplásicas pela sua exposição seletiva à radiação ionizante, a partir de elementos radioativos ligados a moléculas chamadas radioimunoterápicas, que a conduzem até essas células. Assim, a TR é semelhante à quimioterapia, pois é um tratamento sistêmico que utiliza uma molécula capaz de levar níveis tóxicos de radiação apenas para a área tumoral, diferentemente da teleterapia, que também age sobre (e destrói) tecidos normais.
O uso de moléculas sintéticas para combater o câncer - Já existe um grande número de agentes disponíveis para o combate às neoplasias, mas a resistência de alguns tumores e a toxicidade que atinge as células normais têm sido apontadas como as principais causas da falha terapêutica e da perda de vidas nos tratamentos convencionais. Por este motivo, a busca por novos agentes antitumorais vem aumentando nos últimos anos. Considerando seu caráter não invasivo e a relativa baixa toxidade em comparação com a quimioterapia e com a radioterapia convencionais, a terapia radionuclídica está se tornando uma área de grande interesse no tratamento do câncer.
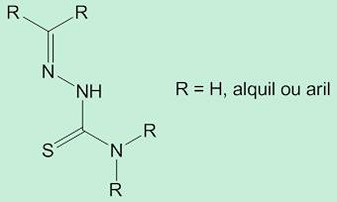 |
| Fig. 1 – Estrutura genérica das tiossemicarbazonas - Divulgação |
Dessa forma, se durante muito tempo a pesquisa de novos fármacos concentrou-se principalmente no estudo de compostos orgânicos e produtos naturais, em 1965 teve início a avaliação do perfil farmacológico de produtos inorgânicos sintéticos, após a descoberta da atividade antitumoral da cisplatina [cis(diaminodicloro)platina], pelo físico Barnett Rosemberg. Desde então, novas moléculas sintéticas vêm sendo amplamente estudadas.
Hoje, compostos derivados de bases de Schiff, tais como tiossemicarbazonas (Fig. 1), constituem uma importante classe de compostos orgânicos sintéticos de fácil estocagem e insensíveis à luz, podendo ser empregados em diversas situações.
Vários isótopos têm sido utilizados com sucesso para o tratamento de muitos distúrbios, com destaque para o fósforo-32 (P-32), o estrôncio-89 (Sr-89), o rádio-223 (Ra-223), o ítrio-90 (Y-90), o iodo-131 (I-131) e o samário-153 (Sm-153). Mas, a escolha do isótopo radioativo mais adequado para o tratamento de uma neoplasia depende das características do tumor.
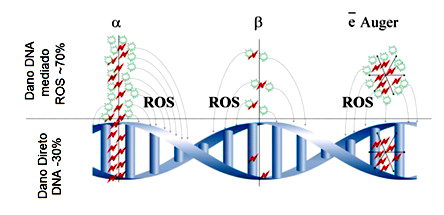 |
| Fig. 2 - Elétrons Auger formam clusters com alta densidade de ionização - Divulgação |
Por exemplo, os que emitem partículas Beta (β), de alta energia, fornecem radiação com penetração profunda para o tratamento de tumores sólidos volumosos, enquanto os emissores de elétrons Auger são, em princípio, mais apropriados para a terapia de pequenos aglomerados de células cancerosas ou pequenos tumores. Recentemente, investigações sobre isótopos radioativos emissores de elétrons Auger (o nome vem de um de seus descobridores, Pierre Victor Auger) para o uso na TR mostraram resultados muito promissores.
Os emissores de elétrons Auger decaem, em um processo complexo, em cascata, que acaba resultando na emissão de uma chuva de elétrons de baixa energia no microambiente imediato em torno do local de decaimento. Assim, os emissores de elétrons Auger podem atingir uma alta eficácia biológica relativa (RBE, na sigla em inglês), associada a danos no DNA e à morte celular.
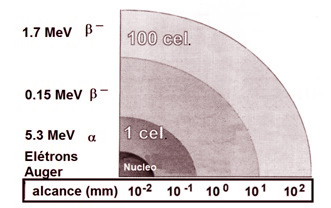 |
| Fig. 3 - Correlação entre tipo de energia de radiação e o alcance no tecido - Divulgação |
A pesquisadora Este endereço de email está sendo protegido de spambots. Você precisa do JavaScript ativado para vê-lo., responsável por estes trabalhos no CDTN, destaca que os radioisótopos iodo-125 (I-125), iodo-123 (I-123), tecnécio-99m (Tc-99m), platina-93m (Pt-193m), platina-195m (Pt-195m) e índio-111 (In-111) são os emissores de elétrons Auger mais amplamente investigados para estes tratamentos. Mas, ressalta que alguns isótopos ainda são pouco explorados para aplicação terapêutica.
“Nossa linha de pesquisa visa a investigação do potencial terapêutico de isótopos emissores de elétrons Auger ainda inexplorados para a síntese de radiocomplexos para terapia radionuclídica”, acrescenta Raquel. Ela enfatiza que elétrons Auger possuem alto poder de ionização, comparável às partículas alfa (Fig. 2) e com curto alcance (Fig. 3) nas células e, por isto, seriam excelentes ferramentas para terapia de tumores pequenos, com reduzidos efeitos colaterais em células e tecidos saudáveis vizinhos. Assim, segundo a pesquisadora do CDTN, o uso de radiofármacos contendo emissores de elétrons Auger possibilita um efeito mais concentrado no tumor, minimizando os danos ao tecido saudável vizinho a região tumoral.
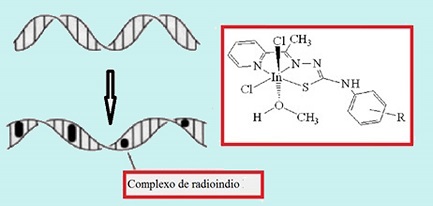 |
| Fig. 4 - Complexos de In-114m foram tóxicos para câncer de mama - Divulgação |
Para Raquel, embora o radioisótopo metaestável In-114m tenha sido considerado como impureza indesejável na produção de radiofármacos In-111, existe um interesse crescente em estudar compostos de In-114m para Terapia de Radionuclídeos, devido à quantidade substancial de elétrons Auger presentes. Como a investigação sobre candidatos a drogas terapêuticas à base de índio permanecia praticamente inexplorada, um trabalho recente foi desenvolvido em parceria com a doutora Este endereço de email está sendo protegido de spambots. Você precisa do JavaScript ativado para vê-lo., do Departamento de Química da Universidade Federal de Minas Gerais (UFMG), onde foram preparados complexos de índio não radioativos com tiossemicarbazonas derivadas da 2-acetilpiridina. Segundo a pesquisadora do CDTN, os compostos exibiram potentes atividades citotóxicas contra leucemia humana e células tumorais sólidas.
Em seguida, foi produzido por ativação neutrônica, no reator Triga Mark IPR 1 do CDTN, o isótopo In-114m, com o que foram sintetizados os novos complexos de índio baseados em tiossemicarbazonas. Segundo Raquel Gouvea, esses radiocomplexos foram capazes de interagir com o DNA (Fig. 4).
 |
| Fig. 5 - Alterações morfológicas nas células de tumores mamários, sendo os complexos radioativos representados pelo asterisco (*) - Divulgação |
Como resultado, tanto os complexos não-radioativos, quanto os radioativos provocaram alterações morfológicas nas células de tumores mamários, tais como encolhimento e formas arredondadas, consistentes com o processo de morte por apoptose (Fig. 5). No entanto, de acordo com a pesquisadora do CDTN, é possível observar que os complexos radioativos induziram efeitos tóxicos em tumores de mama muito superiores ao de seus análogos não radioativos.
Segundo Raquel, o tipo de morte celular induzida pelos complexos de índio (Fig. 6) também foi investigado. As células tratadas com o complexo não-radioativo apresentaram autofagossomas ácidos (setas amarelas) e condensação do DNA (setas azuis), indicando morte por apoptose (Fig. 6b). Por sua vez, as células tratadas com complexo radioativo apresentaram núcleo de coloração laranja avermelhada decorrente da cromatina altamente fragmentada, indicando apoptose tardia ou necrose (Fig. 6c).
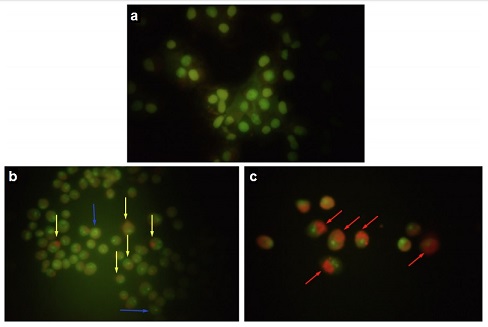 |
| Fig. 6 – Efeito dos complexos de índio no DNA de células tumorais: a) Células não tratadas (grupo controle); b) Células tratadas com complexo de índio não radioativo; c) Células tratadas com complexo de índio radioativo - Divulgação |
O autofagossoma é um mecanismo da célula de eliminação de organelas defeituosas por meio do seu englobamento em uma vesícula, formada a partir de uma membrana que se funde nas extremidades e origina uma estrutura fechada, com duas camadas de membranas. Isto é feito pela célula para garantir que as enzimas degradem somente o necessário e não sejam liberadas no interior da própria célula. Já a apoptose é um programa que mata as próprias células que o iniciam, de maneira controlada e ordenada, em um processo conhecido como morte celular programada. E, diferente da apoptose, a necrose já é um processo patológico e desordenado da morte celular.
“Estes resultados foram muito animadores e motivaram novos estudos investigando outros tumores como os tumores cerebrais malignos, glioblastoma multiforme”, destaca a pesquisadora. “Pacientes com glioblastoma multiforme geralmente têm um prognóstico ruim e tendo uma estimativa de sobrevida de apenas 50% após o primeiro ano do diagnóstico”, completa Raquel Gouvea.
Mais recentemente, com o intuito de dar continuidade nos estudos de novos compostos radioativos de índio com tiossemicarbazonas, a pós-doutoranda Este endereço de email está sendo protegido de spambots. Você precisa do JavaScript ativado para vê-lo. teve seu projeto com estudos do gálio aprovado junto à CNEN e foi incorporada ao grupo de pesquisa de Raquel Gouvea dos Santos. A proposta é dar impulso ao desenvolvimento de complexos de índio com novas estruturas de tiossemicarbazonas, para aprofundar os estudos usando outras linhagens e investigar o mecanismo de ação que acarreta a morte celular.
Este endereço de email está sendo protegido de spambots. Você precisa do JavaScript ativado para vê-lo. - jornalista

Redes Sociais